De signalen die veel van de meest essentiële functies van de hersenen en het lichaam aansturen – bewustzijn, slaap, ademhaling, hartslag en beweging – gaan door bundels ‘witte stof’-vezels in de hersenstam, maar beeldvormingssystemen zijn er tot nu toe niet in geslaagd deze cruciale neurale kabels nauwkeurig op te lossen. Hierdoor hebben onderzoekers en artsen weinig mogelijkheden om te beoordelen hoe zij worden beïnvloed door trauma of neurodegeneratie.
In een nieuwe studie onthult een team van onderzoekers van MIT, Harvard University en Massachusetts General Hospital AI-aangedreven software die in staat is om automatisch acht verschillende bundels te segmenteren in elke diffusie-MRI-sequentie.
In het open access onderzoek, gepubliceerd op 6 februari i Proceedings van de National Academy Sciences, Het onderzoeksteam onder leiding van MIT-student Mark Olchanyi meldt dat hun BrainStem Bundle Tool (BSBT), die ze publiekelijk beschikbaar hebben gemaakt, duidelijke patronen van structurele veranderingen aan het licht bracht bij patiënten met de ziekte van Parkinson, multiple sclerose en traumatisch hersenletsel, en ook licht werpt op de ziekte van Alzheimer. Bovendien laat het onderzoek zien dat BSBT het met terugwerkende kracht mogelijk maakte om bundelgenezing bij een comateuze patiënt te volgen, wat de zeven maanden durende weg naar herstel van de patiënt weerspiegelt.
“De hersenstam is een deel van de hersenen dat in wezen onontgonnen is omdat het moeilijk in beeld te brengen is”, zegt Olchanyi, een promovendus bij het Medical Engineering and Medical Physics Program van MIT. “Mensen begrijpen de samenstelling ervan niet echt vanuit een beeldvormend perspectief. We moeten begrijpen wat de organisatie van de witte stof bij mensen is en hoe die organisatie bij bepaalde aandoeningen uiteenvalt.”
Professor Emery N. Brown, Olchanyi’s scriptiebegeleider en co-senior auteur van het onderzoek, voegt hieraan toe: “De hersenstam is een van de belangrijkste controlecentra van het lichaam. De algoritmen van Mark leveren een belangrijke bijdrage aan beeldvormingsonderzoek en aan ons vermogen om de regulatie van fundamentele fysiologie te begrijpen. Door ons vermogen te verbeteren om de hersenstam in beeld te brengen voor de vitale fysiologische toegang en fysiologische controle, biedt hij ons nieuwe fysiologische en ademhalingscontrole. Cardiovasculaire systemen, temperatuurregulatie, hoe we ons gedragen overdag wakker en ‘s nachts slapen.”
Brown is de Edward Hood Taplin hoogleraar Computational Neuroscience and Medical Engineering aan het Picower Institute for Learning and Memory, het Institute for Medical Engineering and Science, en het Department of Brain and Cognitive Sciences aan het MIT. Hij is ook anesthesioloog bij MGH en professor aan de Harvard Medical School.
Structuur van het algoritme
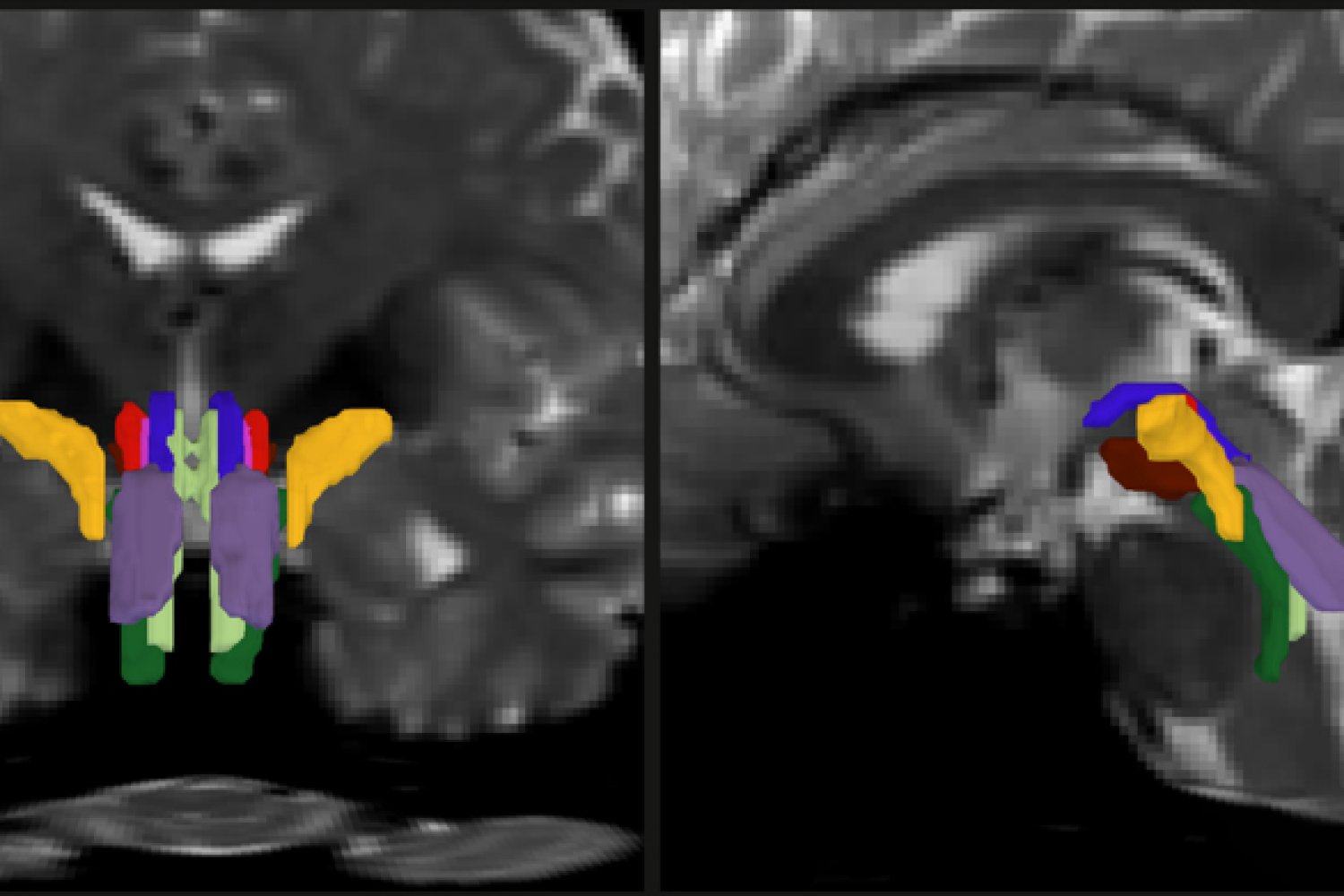
Diffusie-MRI helpt bij het traceren van de lange takken, of ‘axonen’, die neuronen uitstrekken om met elkaar te communiceren. Axonen zijn doorgaans bedekt met een omhulsel van vet dat myeline wordt genoemd, en water diffundeert langs de axonen in de myeline, die ook wel de ‘witte stof’ van de hersenen wordt genoemd. Diffusie-MRI kan deze sterk gerichte verplaatsing van water benadrukken. Maar het segmenteren van de verschillende bundels axonen in de hersenstam is een uitdaging gebleken, omdat ze klein zijn en worden gemaskeerd door stromen hersenvocht en bewegingen die worden veroorzaakt door ademhaling en hartslag.
Als onderdeel van zijn proefschrift om de neurale mechanismen die ten grondslag liggen aan het bewustzijn beter te begrijpen, wilde Olchanyi een AI-algoritme ontwikkelen om deze obstakels te overwinnen. BSBT werkt door het traceren van vezelbundels die in de hersenstam afdalen vanuit aangrenzende gebieden hoger in de hersenen, zoals de thalamus en het cerebellum, om een ’waarschijnlijkheidsvezelkaart’ te produceren. Een kunstmatige-intelligentiemodule, een “convolutioneel neuraal netwerk” genoemd, combineert vervolgens de meerkanaalskaart met beeldinformatie uit de hersenstam om onderscheid te maken tussen acht individuele bundels.
Om het neurale netwerk te trainen om de bundels te segmenteren, “liet” Olchanyi het dertig live diffusie-MRI-scans zien van vrijwilligers in het Human Connectome Project (HCP). De scans werden handmatig geannoteerd om het neurale netwerk te leren hoe de bundels te identificeren. Vervolgens valideerde hij de BSBT door de resultaten ervan te testen aan de hand van ‘grondwaarheid’-dissecties van post-mortem menselijke hersenen, waarbij de bundels goed waren afgebakend via microscopische inspectie of zeer langzame beeldvorming met ultrahoge resolutie. Na de training werd BSBT bedreven in het automatisch identificeren van de acht verschillende vezelbundels in nieuwe scans.
In een experiment om de consistentie en betrouwbaarheid ervan te testen, liet Olchanyi BSBT de bundels vinden bij 40 vrijwilligers die twee maanden na elkaar afzonderlijke scans ondergingen. In elk geval kon de tool in elk van hun twee scans dezelfde bundels bij dezelfde patiënten vinden. Olchanyi testte BSBT ook met meerdere datasets (niet alleen de HCP) en inspecteerde zelfs hoe elke component van het neurale netwerk bijdroeg aan de analyse van BSBT door ze één voor één te verhogen.
“We hebben het neurale netwerk door de wringer gehaald”, zegt Olchanyi. “We wilden er zeker van zijn dat het deze plausibele segmentaties daadwerkelijk uitvoert, en dat het elk van zijn afzonderlijke componenten gebruikt op een manier die de nauwkeurigheid verbetert.”
Potentiële nieuwe biomarkers
Nadat het algoritme goed was getraind en gevalideerd, ging het onderzoeksteam verder met testen of het vermogen om verschillende vezelbundels te segmenteren in diffusie-MRI-scans het mogelijk zou maken om te volgen hoe het volume en de structuur van elke bundel varieerde met ziekte of letsel, waardoor een nieuw soort biomarker ontstond. Hoewel de hersenstam moeilijk in detail te bestuderen is, tonen veel onderzoeken aan dat neurodegeneratieve ziekten de hersenstam aantasten, vaak in een vroeg stadium van hun progressie.
Olchanyi, Brown en hun coauteurs pasten BSBT toe op tientallen datasets van diffusie-MRI-scans van patiënten met de ziekte van Alzheimer, Parkinson, MS en traumatisch hersenletsel (TBI). Patiënten werden in de loop van de tijd vergeleken met controles en soms met zichzelf. In de scans mat het hulpmiddel het bundelvolume en de ‘fractionele anisotropie’ (FA), die bijhoudt hoeveel water langs de gemyeliniseerde axonen stroomt versus hoeveel er in andere richtingen diffundeert, een maatstaf voor de structurele integriteit van de witte stof.
In elke conditie vond de tool consistente patronen van veranderingen in de bundels. Terwijl slechts één bundel significante afnames liet zien bij de ziekte van Alzheimer, onthulde de tool bij Parkinson een vermindering van FA in drie van de acht bundels. Het onthulde ook volumeverlies bij een andere groep patiënten tussen een baselinescan en een follow-up van twee jaar. Patiënten met MS lieten de grootste FA-reductie zien in vier bundels en volumeverlies in drie. Ondertussen vertoonden TBI-patiënten in geen enkele bundel een significant volumeverlies, maar in de meeste bundels was een vermindering van de FA zichtbaar.
Uit tests in het onderzoek bleek dat de BSBT nauwkeuriger bleek te zijn dan andere classificatiemethoden bij het maken van onderscheid tussen patiënten met gezondheidsproblemen versus controles.
BSBT kan daarom “een belangrijke aanvulling zijn om de huidige diagnostische beeldvormingsmethoden te ondersteunen door een fijnkorrelige beoordeling te bieden van de structuur van de witte stof in de hersenstam en, in sommige gevallen, longitudinale informatie”, schreven de auteurs.
Ten slotte paste Olchanyi in het geval van een 29-jarige man met ernstig traumatisch hersenletsel BSBT toe op een scan die was gemaakt tijdens de zeven maanden durende coma van de man. Het instrument toonde aan dat de hersenstambundels van de man waren verplaatst maar niet waren doorgesneden, en dat de laesies op de zenuwbundels tijdens zijn coma met een factor drie in volume waren afgenomen. Terwijl ze genezen, kwamen de bundels ook weer op hun plaats.
De auteurs schreven dat BSBT “een aanzienlijk prognostisch potentieel heeft door bewaarde hersenstambundels te identificeren die comaherstel kunnen vergemakkelijken.”
De andere senior auteurs van de studie zijn Juan Eugenio Iglesias en Brian Edlow. Andere co-auteurs zijn David Schreier, Jian Li, Chiara Maffei, Annabel Sorby-Adams, Hannah Kinney, Brian Healy, Holly Freeman, Jared Shless, Christophe Destrieux en Hendry Tregidgo.
De financiering voor de studie kwam van de National Institutes of Health, het Amerikaanse ministerie van Defensie, James S. McDonnell Foundation, Rappaport Foundation, American SidS Institute, American Brain Foundation, American Academy of Neurology, Center for Integration of Medicine and Innovative Technology, Blueprint for Neuroscience Research en Massachusetts Life Sciences Center.